재생불량성 빈혈, 급성백혈병 유발
[에너지단열경제]이승범 기자

대표적인 방향족 화합물로, 가연성이 있는 무색 액체이다.
주로 석유로부터 생산되지만 코크스를 생산하는 과정에서 부산물로 얻어지기도 한다.
벤젠(benzene)은 1825년 영국의 물리학자인 마이클 패러데이(Michael Faraday)에 의해 고래기름으로 만든 조명용가스에서 처음 발견되었으며, 1845년 독일의 폰 호프만(August Wilhelm von Hofmann)이 콜타르에서 추출하여 벤젠이란 이름을 붙였다.
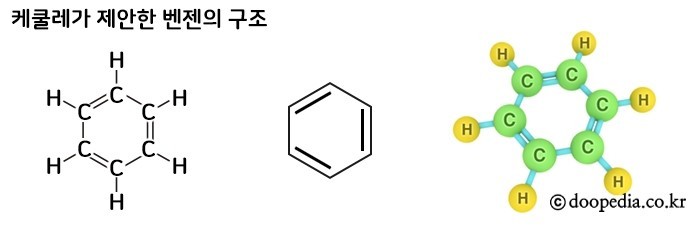
이후 1865년 독일의 케쿨레(Friedrich August Kekulé von Stradonit)에 의해 벤젠고리 구조가 제안되었다.
벤젠은 6개의 탄소원자가 거북이의 등껍질을 닮은 육각형 모양으로 연결되어 있고, 각 탄소원자에 수소원자가 하나씩 붙어있는 단순한 구조의 화학물질이다.
벤젠의 육각형 구조를 ‘벤젠고리’라고도 하며, 다른 여러 방향족 화합물의 기본이 된다.
벤젠 및 벤젠고리를 포함하는 화합물들은 휘발성이 있고 독특한 향이 있어서 방향족이란 이름이 붙었다.
벤젠은 휘발성이 강한 무색의 액체이며 염료, 향료, 살충제, 합성세제, 약품 등 여러 화학 합성품의 원료로 사용된다.
예전에는 세탁소의 드라이크리닝 용매로 많이 사용하였으나, 독성이 알려진 이후로는 거의 사용되지 않고 있다.
물에 섞이지 않고(무극성), 알코올 · 에테르 · 아세톤 등에 잘 녹으며, 유지나 수지 등을 잘 녹인다.
이 때문에 유기 합성 공업 원료, 휘발유의 옥탄가를 증가시키기 위하여 첨가하는 첨가제, 합성 세제 원료 및 각종 용제 등에 주로 쓰인다.
벤젠은 분자식이 C6H6로, 정육각형 모양의 분자이다.
벤젠의 실제 구조는 단일결합과 이중결합이 고정되어 교대로 존재하는 것이 아니고 1.5결합이다.
벤젠 고리에서 탄소-탄소 결합에 참여하는 전자의 수는 총 18개인데, 이 중 12개는 두 개씩 짝을 지어 결합을 형성하면서 총 6개의 단일결합을 이루고, 남은 6개의 전자는 모든 탄소들 사이를 자유롭게 옮겨 다닌다.
그래서 평균적으로 하나의 탄소-탄소 결합에 전자가 하나씩 더 존재하는 것으로 계산되어 1.5결합을 이룬다는 것이다.
이렇게 전자들이 어느 한 곳에 고정되어 있지 않고 분자 사이를 자유롭게 오가기 때문에 공명 구조라고 한다.
벤젠처럼 공명 구조를 갖는 분자들은 비슷한 분자식을 가지면서 공명 구조가 존재하지 않는 분자들에 비해 에너지가 낮은 안정한 분자를 형성한다.
벤젠은 매우 안정적인 분자에 속하기 때문에 반응성이 약하다.
특히 첨가반응은 잘 일어나지 않으며 일어나는 대부분의 반응은 치환반응이다.
벤젠이 일으키는 치환반응에는 할로젠화반응, 나이트로화반응, 설폰화반응, 알킬화반응 등이 있다.
첨가반응이 일어나기는 매우 어렵기 때문에 첨가반응을 진행하고자 할 때는 니켈과 같은 촉매를 이용한다.
수소 3분자와 첨가반응하면 사이클로헥세인이 되고, 염소 3분자와 첨가반응하면 벤젠헥사클로라이드(BHC)가 된다.
벤젠은 첨가반응을 하게 되면 방향성을 잃게 된다.
즉, 뱡향족이 아닌 물질이 되는 것이다.
이걸로 네이팜탄과 비슷한 폭탄의 원료인 나이트로벤젠을 만들 수 있다.
이것을 가공한 것이 광산에서 다이나마이트로 쓰는 TNT다.
산업적으로 벤젠은 주로 다른 화학물질을 만들기 위한 중간 물질이다.
그 가운데 에틸벤젠을 가장 많이 만들고, 이는 플라스틱의 원료인 스티렌 제조에 쓴다.
그 밖에도 수많은 의약품이 벤젠과 치환기들로부터 나온다.
1950년대만 해도 휘발유에 첨가해 쓰기도 했다.
벤젠이 휘발유의 옥탄가를 높이고 노킹을 방지하기 때문인데, 요즘은 독성 때문에 벤젠을 안 넣는다.
벤젠의 독성을 잘 알지 못했던 19세기까지만 해도 좋은 향이 난다고 면도크림에도 넣었다.
<벤젠의 인체 유해성>
벤젠은 암을 일으키는 것으로 공인된 물질이라, 세계보건기구(WHO) 산하 기관인 국제암연구소(IARC)에서 1군 발암물질(암의 발생과 명백한 상관관계가 있다고 확인된 물질)로 지정했다.
벤젠은 다른 질병도 일으킬 가능성이 많다.
벤젠에 노출되면 피로, 두통, 식욕부진 등의 만성중독이 나타나기도 한다.
장기간 노출시 재생불량성 빈혈, 급성 백혈병, 골수 이상 등의 치명적인 질병을 일으키는 것으로 알려져 있다.
신체 기관 중 골수 손상을 유발하는 것으로 유명하고, 그 밖의 다른 기관(간, 뇌, 콩팥, 심장, 폐)에도 타격을 준다.
짧은 시간에 20,000ppm 이상의 고농도 벤젠을 흡입하였을 때에는 5~10분 안에 사망할 수도 있으며, 250~500ppm 정도의 벤젠에 노출되어도 졸음, 현기증, 두통, 메스꺼움 등의 증상이 나타난다.
벤젠은 직업병 발생의 대표적 원인물질의 하나이며, 노동부에서 정한 벤젠을 취급하는 작업장의 노출 기준은 1ppm 이하이다.
벤젠은 휘발성이 강하여 매우 빠르게 기화(氣化)하기 때문에 주로 호흡하는 공기 속에 섞여 우리 몸 속에 들어오며, 자연환경에 방출되는 벤젠은 석유제품 특히 휘발유에 기인한다.
물을 비롯하여 자연상태의 식품에도 벤젠이 소량 존재하며, 음식이나 음료를 통하여 섭취하게 된다.
비흡연자의 경우도 벤젠의 99% 이상을 호흡을 통하여 섭취하는 셈이다.
제2차 세계 대전 때에는 사람을 죽이기 위한 약물주사에 사용된 기록도 있다.
나치 독일 군의관인 에두아르트 크렙슈바흐(Eduard Krebsbach)은 죄수들에게 벤젠을 주사해서 900여명에 달하는 러시아인, 폴란드인, 체코인들을 죽였다.
안식향산나트륨과 식품에 자연적으로 존재하거나 산화방지제 또는 영양 강화등의 목적으로 첨가한 비타민C가 철(Fe), 구리(Cu) 등 금속촉매제의 작용에 의해 화학반응을 일으켜 벤젠(발암물질)이 생성되기도 한다.
현대인의 건강을 해칠 수 있는 벤젠의 주요 섭취경로는 흡연, 매연, 주유소 근무 등이며 식품으로부터의 비의도적 경구 섭취는 심각하게 오염된 토양에서 자란 작물을 섭취하는 것이 아닌 이상 거의 영향을 주지 않는 것으로 알려지고 있다.
[ⓒ 케이아이이뉴스-(구)에너지단열경제. 무단전재-재배포 금지]